腫瘤縮小74.5%,乙肝感染100%清除
新加坡2023年6月5日 /美通社/ — 星漢德生物(SCG),一家專注於感染及其相關癌症的創新免疫療法公司,在法國巴黎舉行的國際細胞與基因治療大會(ISCT) Late-breaking臨床試驗報告會議上,公佈其乙肝抗原特異性T細胞受體(TCR) T細胞療法(研發代號:SCG101)的最新突破臨床數據。
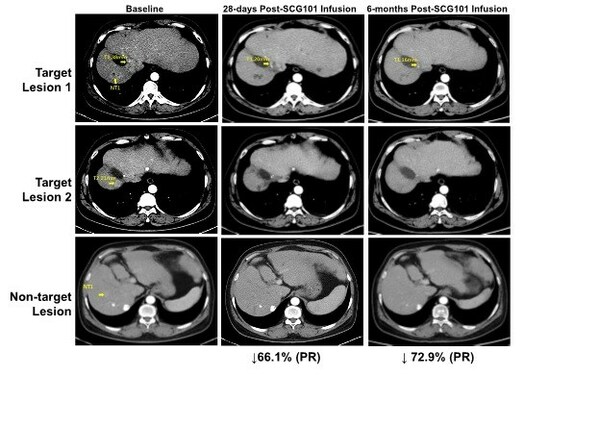
臨床數據顯示,SCG101具有顯著的抗腫瘤和抗病毒活性,一名患有乙型肝炎病毒(HBV)相關肝細胞癌(HCC)患者接受單劑SCG101輸注後,第28天腫瘤靶病灶相比基線縮小66%,達到部分緩解(PR),並在第4個月進一步縮小74.5%;另一處病灶完全消失。試驗期間患者沒有接受任何其他抗腫瘤治療。數據截止時,腫瘤已保持超過6.9個月沒有進展,保持持續緩解狀態。
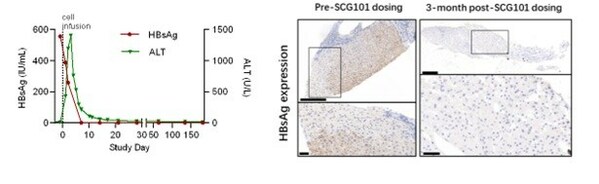
基於回輸前後的肝臟免疫組化分析顯示,乙肝表面抗原陽性肝細胞實現100% 清除,HBV血清學標誌HBsAg從SCG101輸注前的557.96 IU/mL,在輸注後第7天降至1.3 IU/mL,第28天進一步降至0.08 IU/mL。
肝癌是全球第六大常見癌症, 每年新發病例超過90萬。乙型肝炎病毒感染是導致肝癌的主要原因,乙肝病毒相關肝細胞癌占中國肝癌病例超過80%。乙肝病毒感染後,病毒DNA會整合進宿主基因組,可導致宿主細胞基因組不穩定性,表達病毒相關致癌基因,並誘發炎症、氧化應激等反應,引起肝細胞異常再生,最終多種機制共同導致肝細胞癌。
SCG101是一種乙肝抗原特異性的TCR-T細胞療法,可以特異性靶向HBV抗原相關T細胞表位,有效清除HBV-HCC腫瘤細胞、HBV-DNA整合的癌前病變細胞和HBV感染細胞。
星漢德生物首席科學官張柯博士表示:「腫瘤微環境是限制腫瘤免疫治療療效的關鍵屏障。通過靶向和清除腫瘤組織周邊HBsAg陽性肝細胞及HBV整合的癌前病變細胞,可顯著促進SCG101 TCR-T細胞在進入腫瘤微環境之前充分激活和擴增,並通過分泌多重細胞因子調節肝臟固有的免疫抑制微環境,增強T細胞腫瘤浸潤,進而打破免疫耐受、誘發內源性抗腫瘤免疫反應。SCG101的這種獨特機制可以有效地克服T細胞治療在實體瘤中所面臨的一類共同挑戰。」
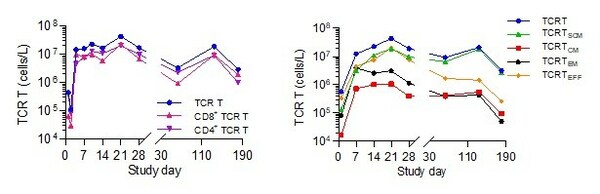
張柯博士補充說:「在免疫相關生物標誌物分析中,SCG101顯示出獨特的CD8/CD4 雙重T細胞功能活性。SCG101輸注後,患者體內TCR-T細胞顯著擴增,表現出良好的CD8+:CD4+ TCR-T比例平衡,有助於強化T細胞相互作用輔助擴增,提升抗腫瘤反應。同時,觀察到高比例的干細胞樣記憶性T細胞(Stem cell-like memory T cell,Tscm)擴增及長期續存,形成特異性記憶T細胞亞群,實現SCG101長期自我更新能力和功能性,維持持續的抗腫瘤和抗病毒效應。」
星漢德生物首席執行官王樹立表示:「SCG101所表現出有效而持久的抗腫瘤和抗病毒功能為患者帶來了巨大獲益,這非常令人振奮,我們期待開發出更多的TCR-T細胞治療產品在攻克實體瘤的進程中發揮更大作用,為更多患者帶來獲益。」
關於SCG101
SCG101是一種針對乙型肝炎表面抗原特異性的自體T細胞受體(TCR) T細胞療法。星漢德生物利用自主研發的獨有GianTTM技術平台,篩選高親力且高結合力的天然TCR,可以有效靶向實體腫瘤中通過主要組織相容性復合體(MHC)表達的細胞內抗原。臨床前和臨床研究數據顯示,SCG101具有腫瘤抑制和HBV cccDNA根除作用,可實現抗腫瘤和抗病毒功能。SCG101已獲美國食品藥品監督管理局(FDA)、中國國家藥品監督管理局(NMPA)、新加坡衛生科學管理局(HSA) 和香港衛生署(DOH)批准用於乙肝感染相關肝癌的臨床試驗。
關於肝細胞癌
肝細胞癌是最常見的肝癌類型,據估計,全球每年有超過90萬例肝癌新發病例,為全球癌症死亡的主要原因之一。乙型肝炎病毒感染是導致肝癌的主要原因,在中國占肝細胞癌病例的超過80%。肝癌發現的時候一般都是晚期,生存時間短、病死率高,5年生存率不足15%。
關於星漢德生物
星漢德生物是一家領先的生物技術公司,專注於開發感染及其相關癌症的新型免疫療法。公司針對最常見的致癌感染:幽門螺桿菌、人乳頭瘤病毒和乙型肝炎,開發廣泛而獨特的TCR-T細胞療法、雙特異抗體和治療性疫苗,實現預防和治癒感染和其相關的癌症的目標。星漢德生物總部位於新加坡,結合新加坡、中國和德國的區域優勢,涵蓋從創新藥物研發、生產、臨床試驗和商業化的完整產業價值鏈。欲瞭解更多關於星漢德生物,請訪問我們的網站www.scgcell.com。
新聞來源:PR Newswire
以上新聞投稿內容由PR Newswire 美通社全權自負責任,若有涉及任何違反法令、違反本網站會員條款、有侵害第三人權益之虞,將一概由PR Newswire 美通社承擔法律及損害賠償之責任,與新頭條Thehubnews無關。